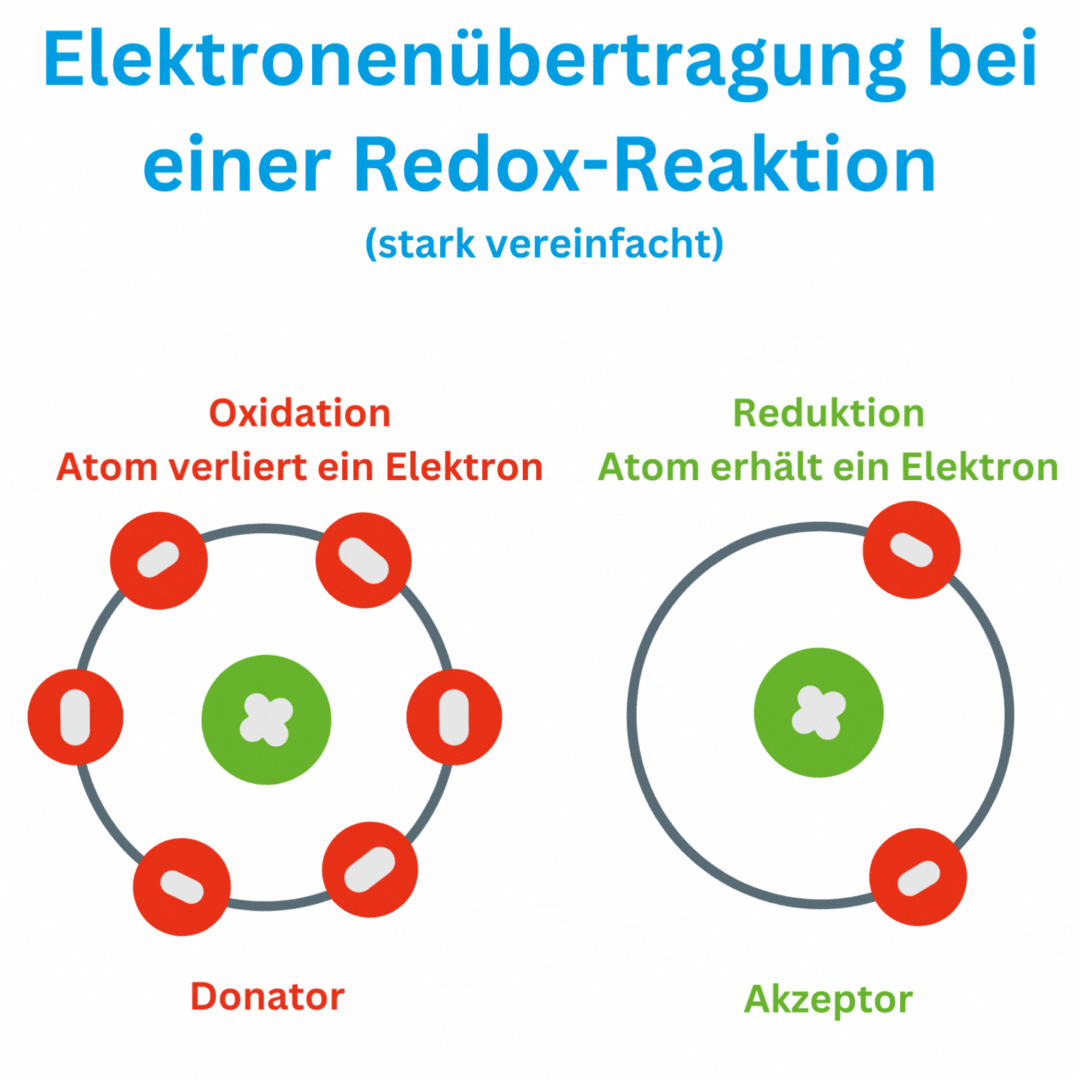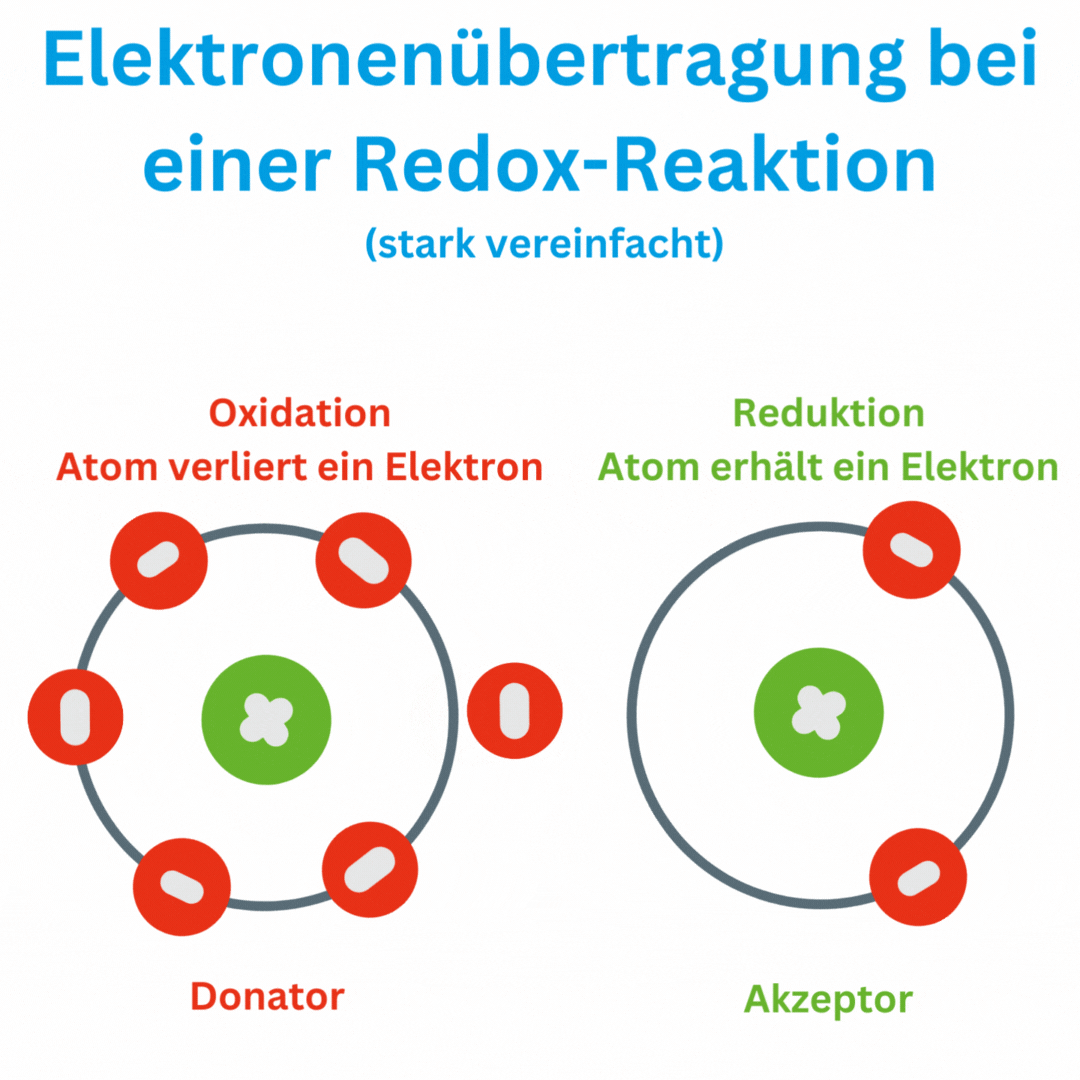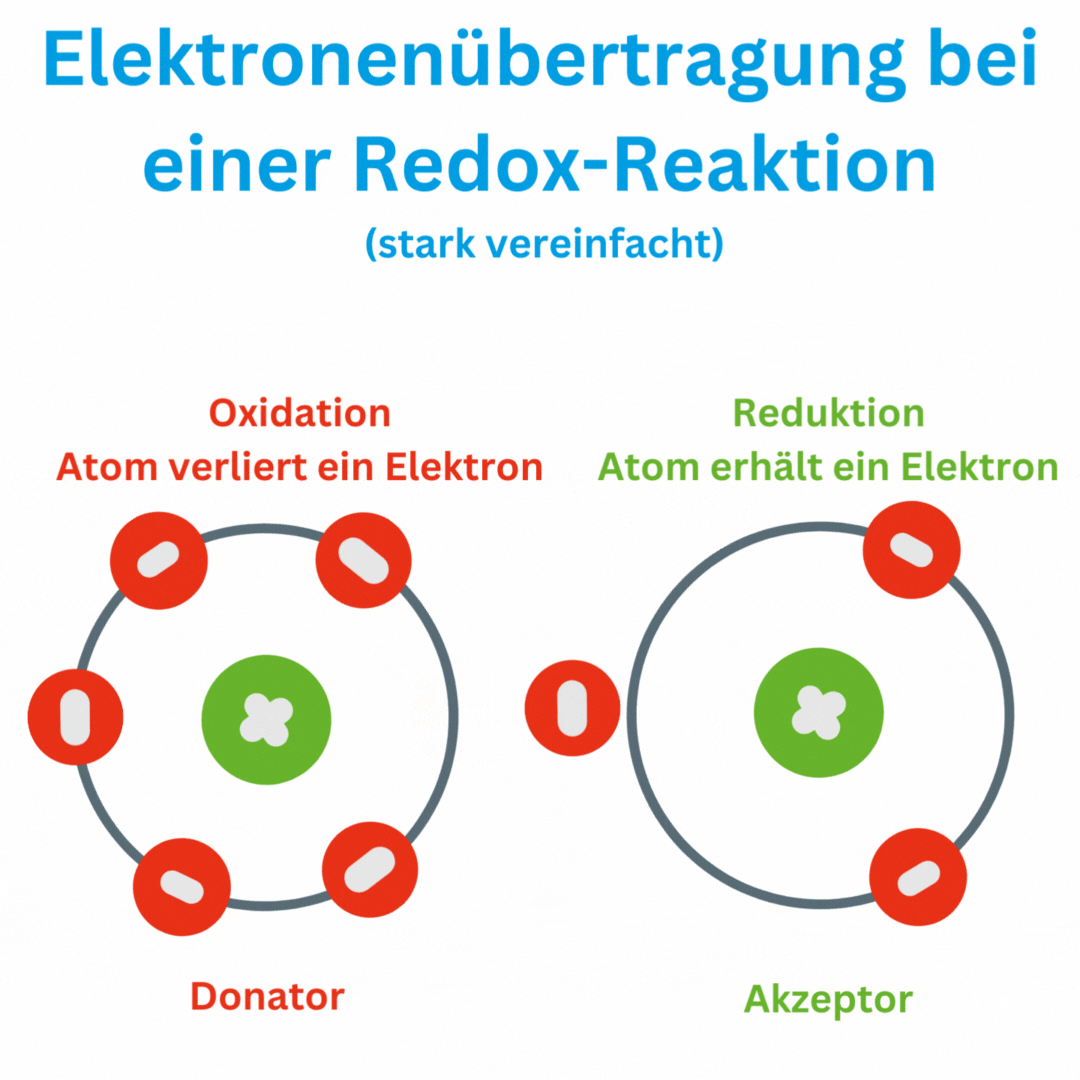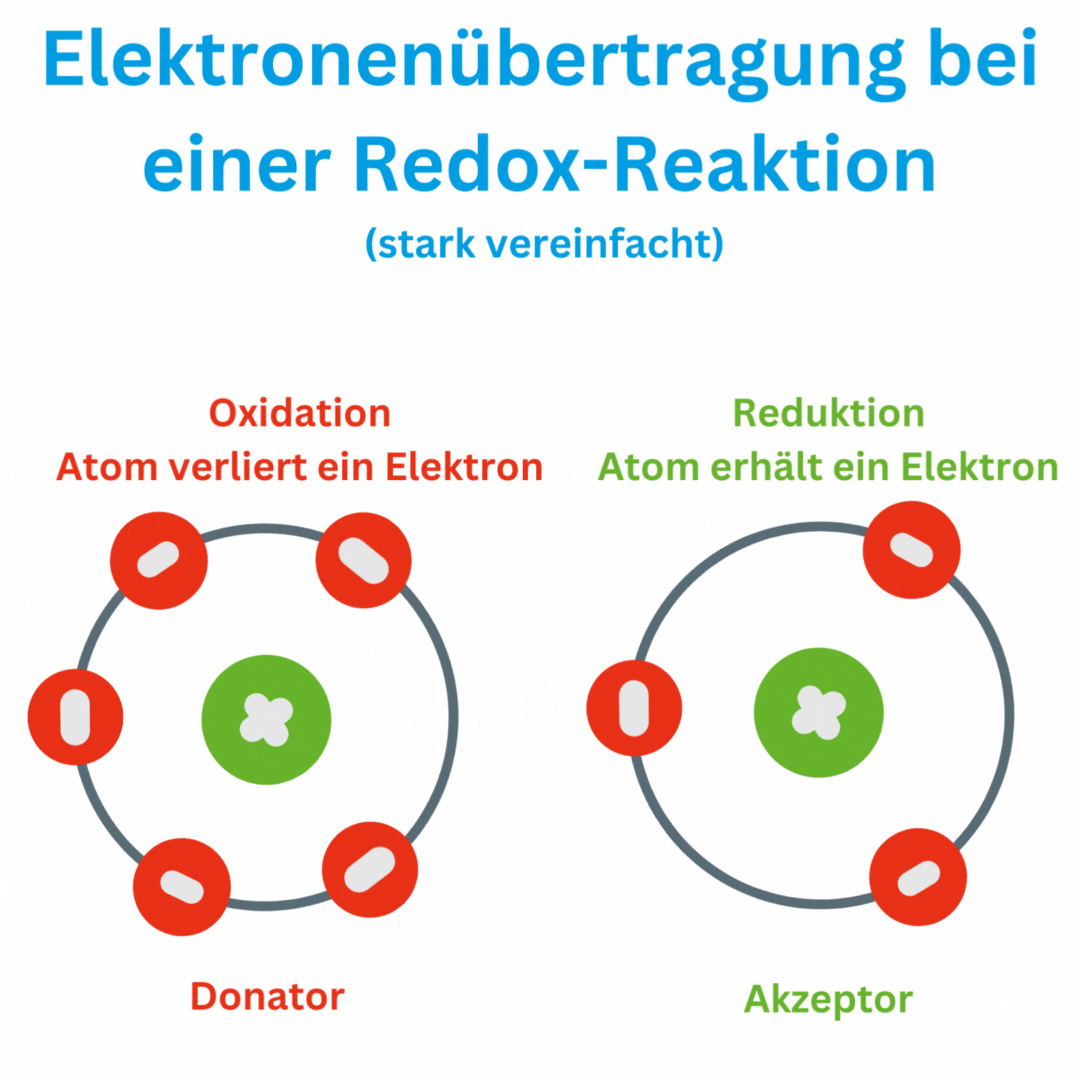
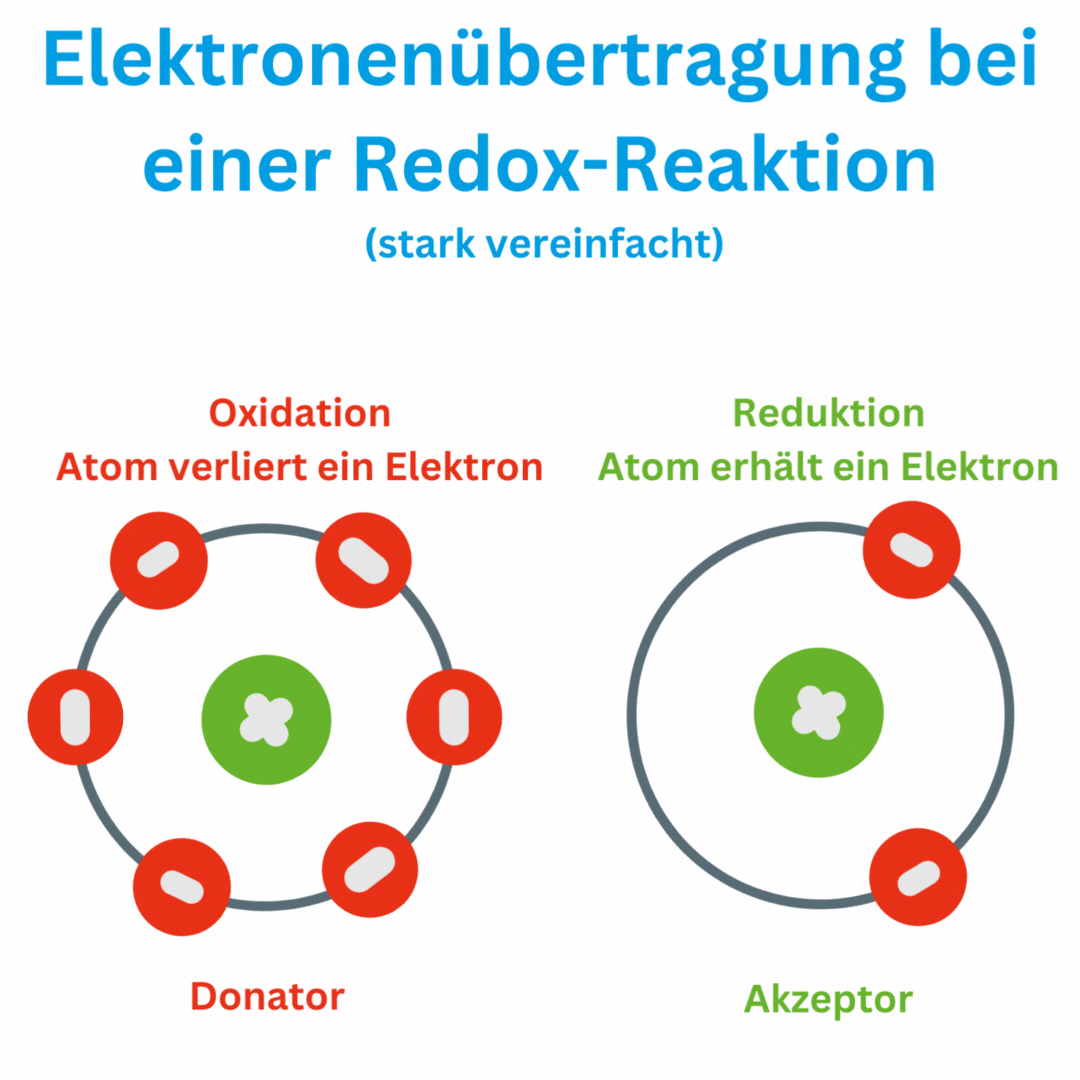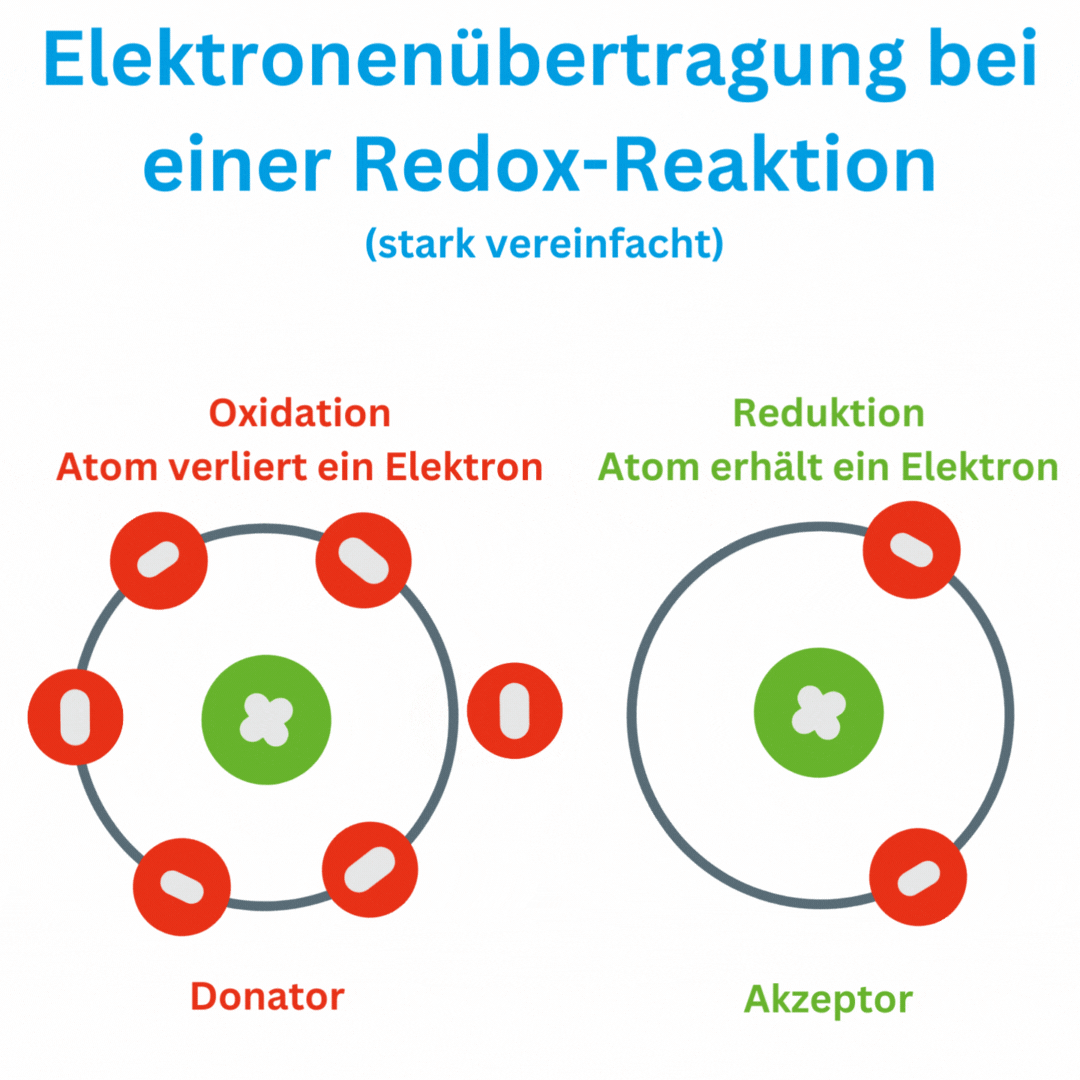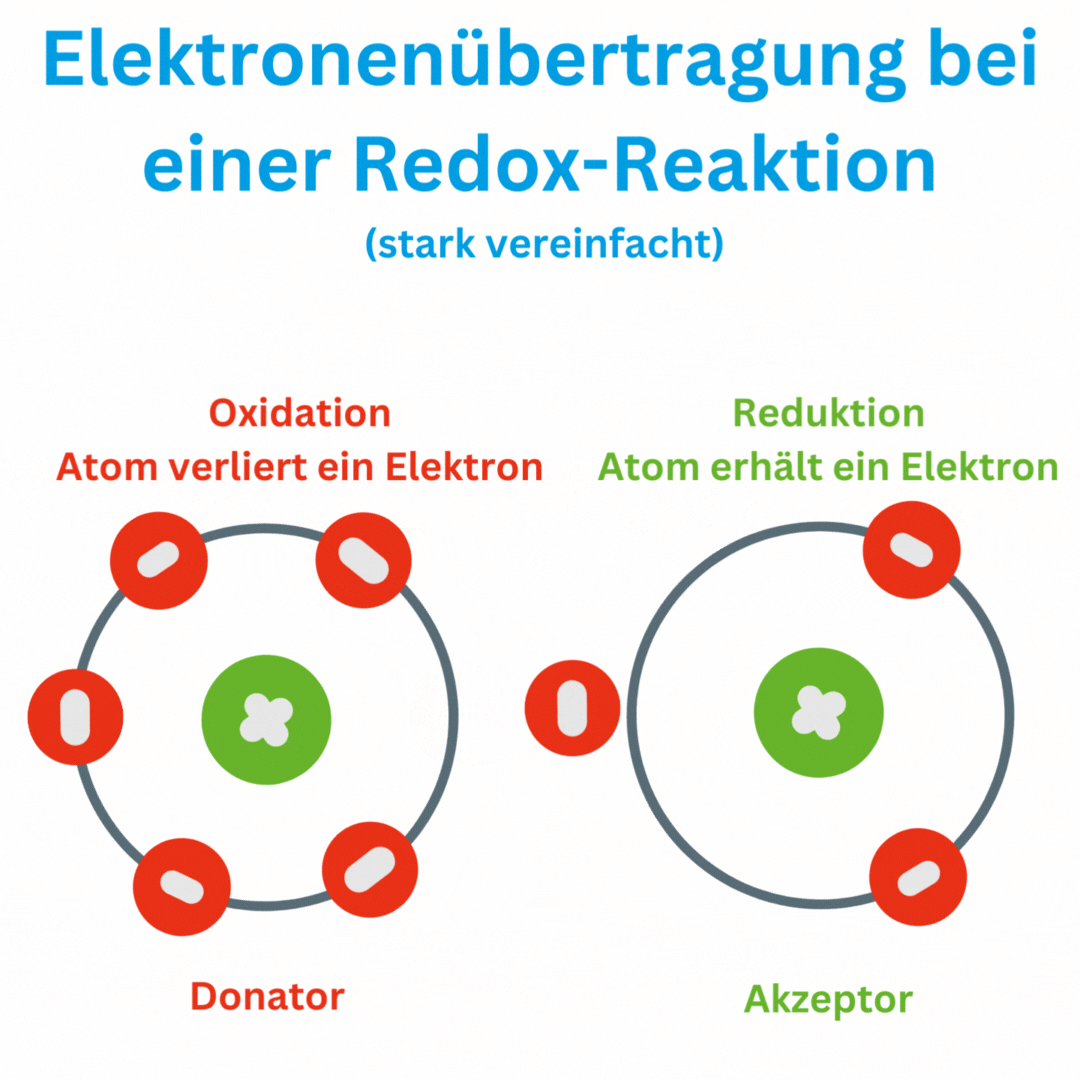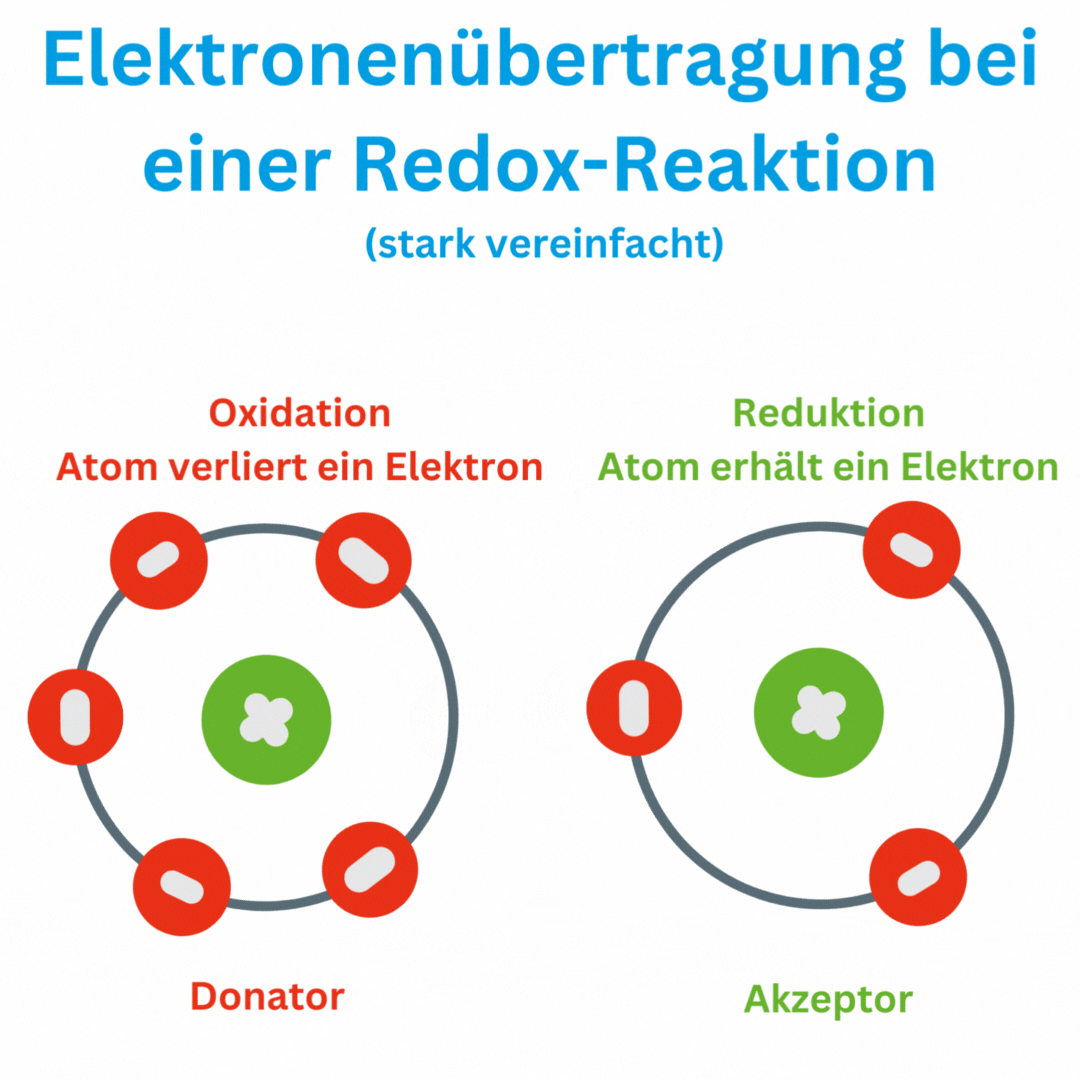
Was bedeutet ein negativer Redox-Wert?
Ja, der Redox-Wert (Oxidations-Reduktions-Potential, ORP) kann auch negative Werte wie -180 mV und tiefer erreichen, abhängig von den chemischen Bedingungen und der Zusammensetzung oder Aufbereitung des Wassers. Ein negatives ORP zeigt an, dass die Lösung oder das Wasser eine eher reduzierende Umgebung aufweist, in der Elektronen aufgenommen und nicht abgegeben werden. Das bedeutet, dass das Trinkwasser antioxidativ ist und somit freie Radikale im Körper beseitigen kann.
Einige Wissenschaftler sind der Meinung, dass es eine wesentliche Rolle spielt ob wir oxidatives oder reduktives Wasser zu uns nehmen. Werner Kollath schreibt in seinem Buch „Regulatoren des Lebens – vom Wesen der Redox-Systeme“ davon oder die Forschung des französischen Wissenschaftlers Lescour, der zwischen „lebendigem“ und „totem“ Wasser in den Heilquelle von Vichy auf Basis des ORP-Wertes unterscheidet.
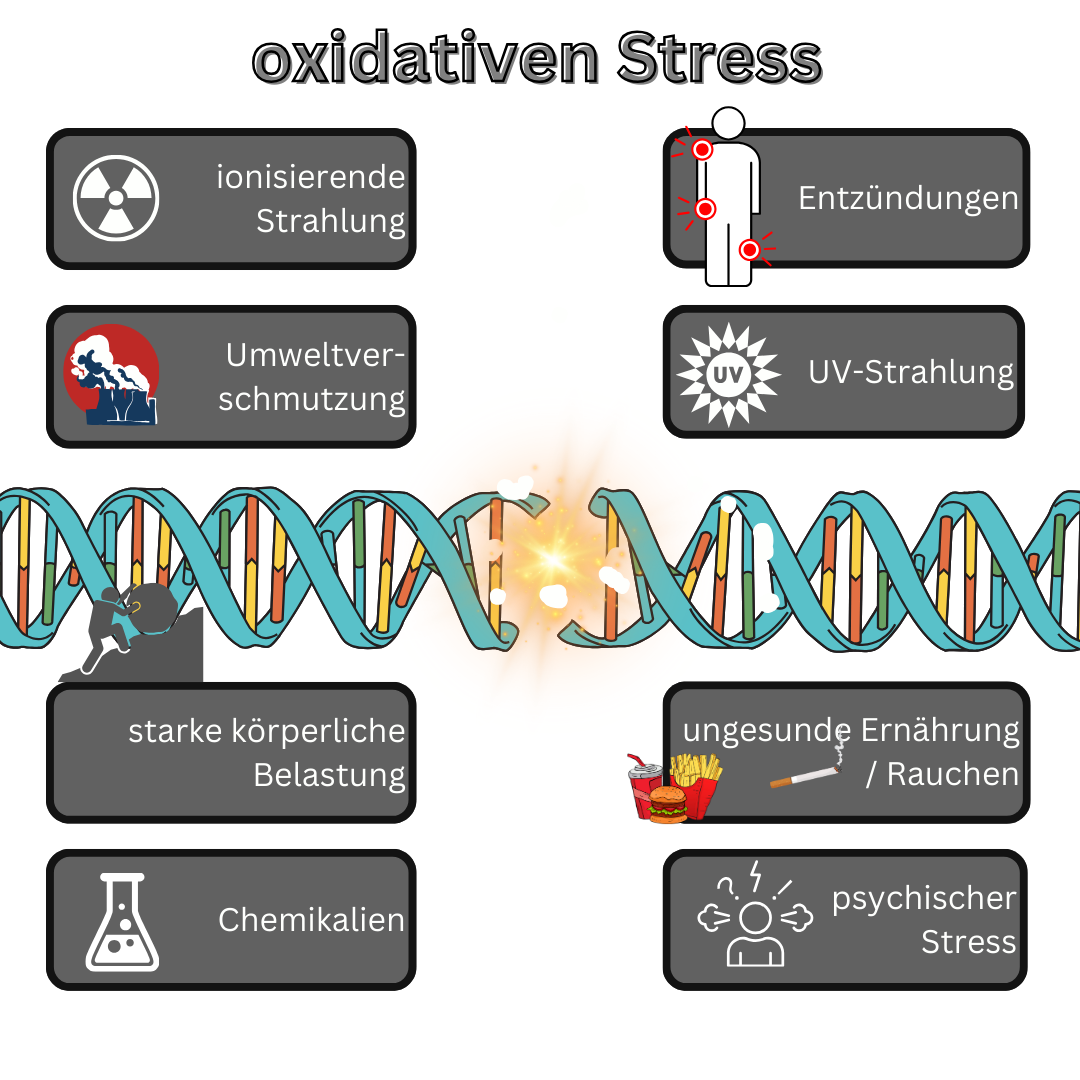
Viele Wissenschaftler vermuten oxidativen Stress als Verursacher mancher Krankheiten, wie z.B. Krebs oder Diabetes. Daher wird zunehmend empfohlen, Antioxidanten wie zum Beispiel Vitamin C zu sich zu nehmen, um diesen Stress vermindern zu können. Auch natürliche Lebensmittel wie Gemüse, Obst und Beeren haben eine natürliche antioxidative Wirkung. Daher ist es sehr naheliegend, dass ein niedrigerer oder negativer Redox-Wert von Trinkwasser auch eine gesunde Wirkung auf unseren Organismus hat.
















Hinterlasse einen Kommentar
Alle Kommentare werden vor der Veröffentlichung geprüft.
Diese Website ist durch hCaptcha geschützt und es gelten die allgemeinen Geschäftsbedingungen und Datenschutzbestimmungen von hCaptcha.