La valeur redox, également connue sous le nom de potentiel d'oxydo-réduction (ORP), est un indicateur important de la réaction chimique des substances présentes dans l'eau. Il indique si une solution a un effet oxydant ou réducteur. Des valeurs redox élevées signifient un environnement oxydant, qui favorise la formation de radicaux libres et est potentiellement nocif pour la santé. De faibles valeurs redox indiquent un environnement réducteur qui a un effet antioxydant et neutralise les radicaux libres. Ces propriétés sont importantes pour la qualité de l’eau et la santé globale. Dans cet article, nous examinerons les propriétés et les liens intéressants avec notre eau potable ainsi que la valeur redox.
. . .
Le potentiel redox ou
La valeur rédox
La valeur rédox, souvent appelée potentiel rédox ou potentiel d'oxydo-réduction (ORP), est un paramètre important lié à l'eau et à la réaction chimique des substances dans une solution. Il fournit des informations sur le degré d’oxydation ou de réduction d’une solution et est souvent utilisé dans l’analyse de la qualité de l’eau et dans divers processus industriels.
En ce qui concerne l’eau potable, elle peut être résumée grossièrement comme suit :
Plus la valeur redox est élevée, plus l'eau est oxydante et donc la formation de radicaux libres (c'est-à-dire l'effet nocif sur l'organisme). Plus la valeur redox est faible, plus l'eau est réductrice et donc l'effet antioxydant de l'eau augmente, ce qui conduit à la réduction des radicaux libres. L'eau devient « plus saine ».
Les radicaux libres peuvent provoquer des dommages cellulaires et des inflammations et sont liés à divers problèmes de santé. Un environnement réducteur créé par de faibles niveaux de rédox dans l’eau contribue à minimiser ces effets nocifs et à promouvoir la santé. Cependant, il est important de noter que le redox à lui seul n’affecte pas tous les aspects sanitaires de l’eau. Il s’agit néanmoins d’un autre point de référence important.
Avant d'approfondir la signification de la valeur rédox, nous aimerions examiner de plus près le stress oxydatif, car celui-ci peut être directement influencé par la valeur rédox de notre eau potable et constitue un facteur d'influence clé pour notre bien-être.
Stress oxydatif
Les processus d'oxydation et de réduction jouent un rôle clé dans le métabolisme cellulaire. Un déséquilibre de ces processus, notamment un excès de radicaux libres, peut entraîner un stress oxydatif et nuire à la santé. Par conséquent, l’équilibre entre l’oxydation et la réduction dans les systèmes biologiques est d’une grande importance.
Oxydation dans les cellules
- L'oxydation est un processus dans lequel les atomes ou les molécules perdent des électrons. Dans les systèmes biologiques tels que les cellules, l’oxydation constitue une partie importante du métabolisme énergétique.
- Un exemple bien connu est la respiration cellulaire, dans laquelle le glucose (sucre) est oxydé dans les cellules pour produire de l'énergie. Les électrons sont transférés du glucose à l'oxygène, créant de l'eau et du dioxyde de carbone.
- Au cours du métabolisme oxydatif dans les cellules, les électrons sont transférés de molécule en molécule et de l'énergie est libérée.
Réduction des cellules
- La réduction est le processus opposé à l’oxydation, dans lequel les atomes ou les molécules gagnent des électrons. Dans les systèmes biologiques, la réduction a souvent lieu pour stocker de l’énergie ou produire des molécules.
- La photosynthèse est un exemple de réaction de réduction dans les cellules. Ici, les molécules de chlorophylle des plantes gagnent des électrons de la lumière et de l’eau pour produire du glucose. Ce processus stocke l'énergie sous forme de glucose.
Radicaux libres et stress oxydatif
- Les radicaux libres sont des molécules très réactives possédant un électron non apparié, ce qui les rend instables.
- Les radicaux libres sont nécessaires avec modération, mais un excès peut provoquer un stress oxydatif. Cela signifie qu’ils endommagent les cellules et les tissus en oxydant (volant des électrons) les molécules saines.
- Le stress oxydatif a été associé à divers problèmes de santé, notamment le vieillissement, les maladies inflammatoires et le cancer.
Les dangers du stress oxydatif
Le stress oxydatif est dangereux car il a des effets néfastes sur les cellules, les tissus et les organes du corps.
Les cellules et les composants cellulaires tels que les lipides, les protéines et l'ADN sont attaqués. Cela entraîne des dommages cellulaires et peut déclencher la mort cellulaire.
L'inflammation dans le corps est favorisée. L’inflammation est une réponse naturelle du système immunitaire, mais l’inflammation chronique causée par le stress oxydatif est liée à de nombreuses maladies, notamment les maladies cardiaques, le diabète et le cancer.
Le processus de vieillissement est accéléré. Le collagène et l'élastine sont endommagés, ce qui entraîne des rides et un relâchement cutané.
Le stress oxydatif est associé à diverses maladies, notamment les maladies cardiaques, les accidents vasculaires cérébraux, le diabète, les maladies neurodégénératives (telles que la maladie d'Alzheimer et la maladie de Parkinson), le cancer et les maladies auto-immunes.
Des dommages à l’ADN peuvent survenir, ce qui peut augmenter le risque de mutations et le développement d’un cancer.
Dans les cas graves de stress oxydatif, des dommages aux tissus et aux organes peuvent survenir. Cela peut affecter le fonctionnement d’organes tels que le foie, les reins et les poumons.
Le stress oxydatif peut affaiblir le système immunitaire et augmenter la susceptibilité aux infections.
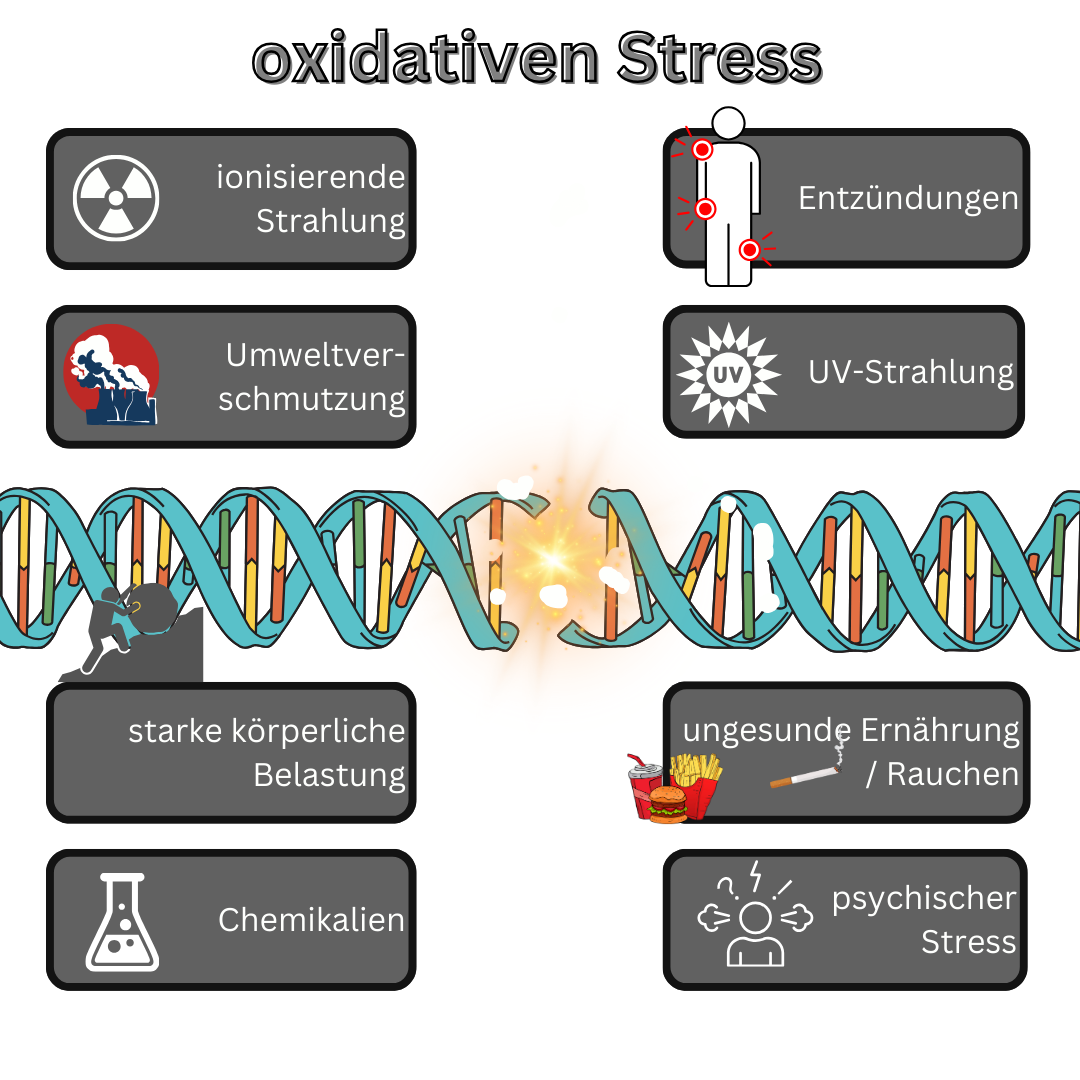
Comment se produit le stress oxydatif ?
- Facteurs externes : Des facteurs externes tels que les rayons UV, la pollution, la fumée de tabac, la consommation d’alcool et les produits chimiques toxiques peuvent augmenter la production de ROS dans l’organisme.
- Inflammation : les processus inflammatoires dans le corps peuvent favoriser la libération du stress oxydatif, car les cellules immunitaires telles que les macrophages produisent des ROS pour se défendre contre les agents pathogènes.
- Alimentation : Une alimentation déséquilibrée, pauvre en nutriments antioxydants tels que les vitamines C et E et en oligo-éléments tels que le zinc et le sélénium, peut limiter la capacité de l'organisme à lutter contre les ROS.
- Vieillissement : Avec l'âge, la capacité de l'organisme à combattre les ROS diminue généralement, ce qui peut entraîner une augmentation du stress oxydatif.
- Maladies : Diverses maladies telles que le diabète, les maladies cardiaques, le cancer et les maladies neurodégénératives peuvent augmenter la production de ROS et altérer les défenses antioxydantes de l'organisme.
Maintenant que nous avons expliqué les effets du stress oxydatif et des radicaux libres, nous allons maintenant examiner de plus près la valeur redox et son importance.
Comment se produit le stress oxydatif ?
- Facteurs externes : Des facteurs externes tels que les rayons UV, la pollution, la fumée de tabac, la consommation d’alcool et les produits chimiques toxiques peuvent augmenter la production de ROS dans l’organisme.
- Inflammation : les processus inflammatoires dans le corps peuvent favoriser la libération du stress oxydatif, car les cellules immunitaires telles que les macrophages produisent des ROS pour se défendre contre les agents pathogènes.
- Alimentation : Une alimentation déséquilibrée, pauvre en nutriments antioxydants tels que les vitamines C et E et en oligo-éléments tels que le zinc et le sélénium, peut limiter la capacité de l'organisme à lutter contre les ROS.
- Vieillissement : Avec l'âge, la capacité de l'organisme à combattre les ROS diminue généralement, ce qui peut entraîner une augmentation du stress oxydatif.
- Maladies : Diverses maladies telles que le diabète, les maladies cardiaques, le cancer et les maladies neurodégénératives peuvent augmenter la production de ROS et altérer les défenses antioxydantes de l'organisme.
Maintenant que nous avons expliqué les effets du stress oxydatif et des radicaux libres, nous allons maintenant examiner de plus près la valeur redox et son importance.

Valeur redox et réaction redox
La valeur rédox, également souvent (à tort - voir ci-dessous) appelée potentiel rédox ou potentiel d'oxydo-réduction (ORP), est mesurée en unités de millivolts (mV). La valeur redox est généralement mesurée avec un compteur redox ou un capteur redox, qui utilise une électrode électrochimique pour détecter la tension électrique entre la solution et une électrode de référence.
La valeur redox optimale pour l’eau potable peut dépendre des exigences spécifiques et des conditions locales. Dans le traitement et la distribution d’eau potable, une valeur ORP positive est courante, indiquant un environnement plus oxydant. Une plage typique recommandée pour l’ORP dans l’eau potable se situe généralement entre +200 mV et +500 mV. Cette zone est destinée à garantir que l'eau potable est exempte de micro-organismes pathogènes et d'agents pathogènes et sert donc de « désinfection légère » .
Voici quelques aspects importants liés à la valeur redox de l’eau :
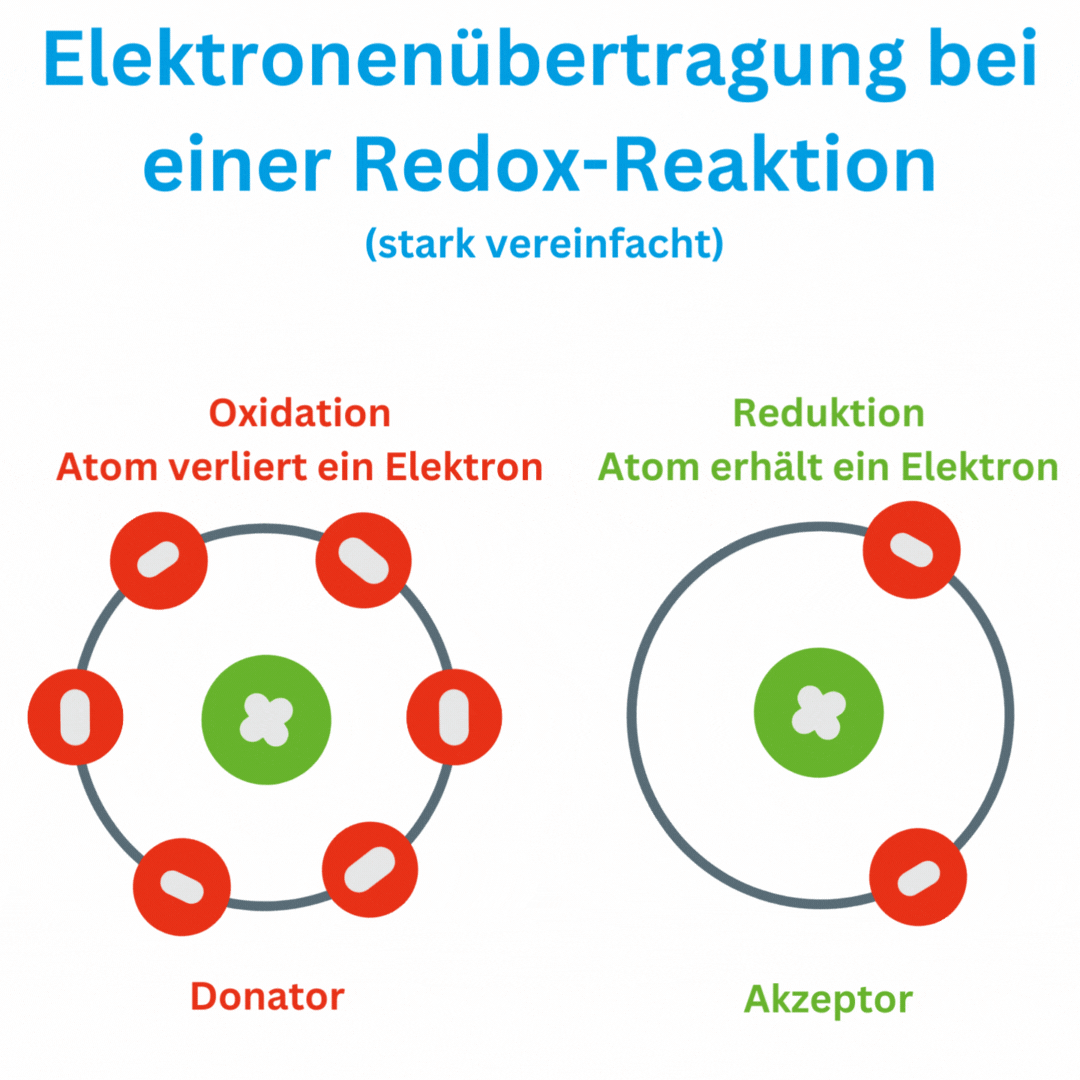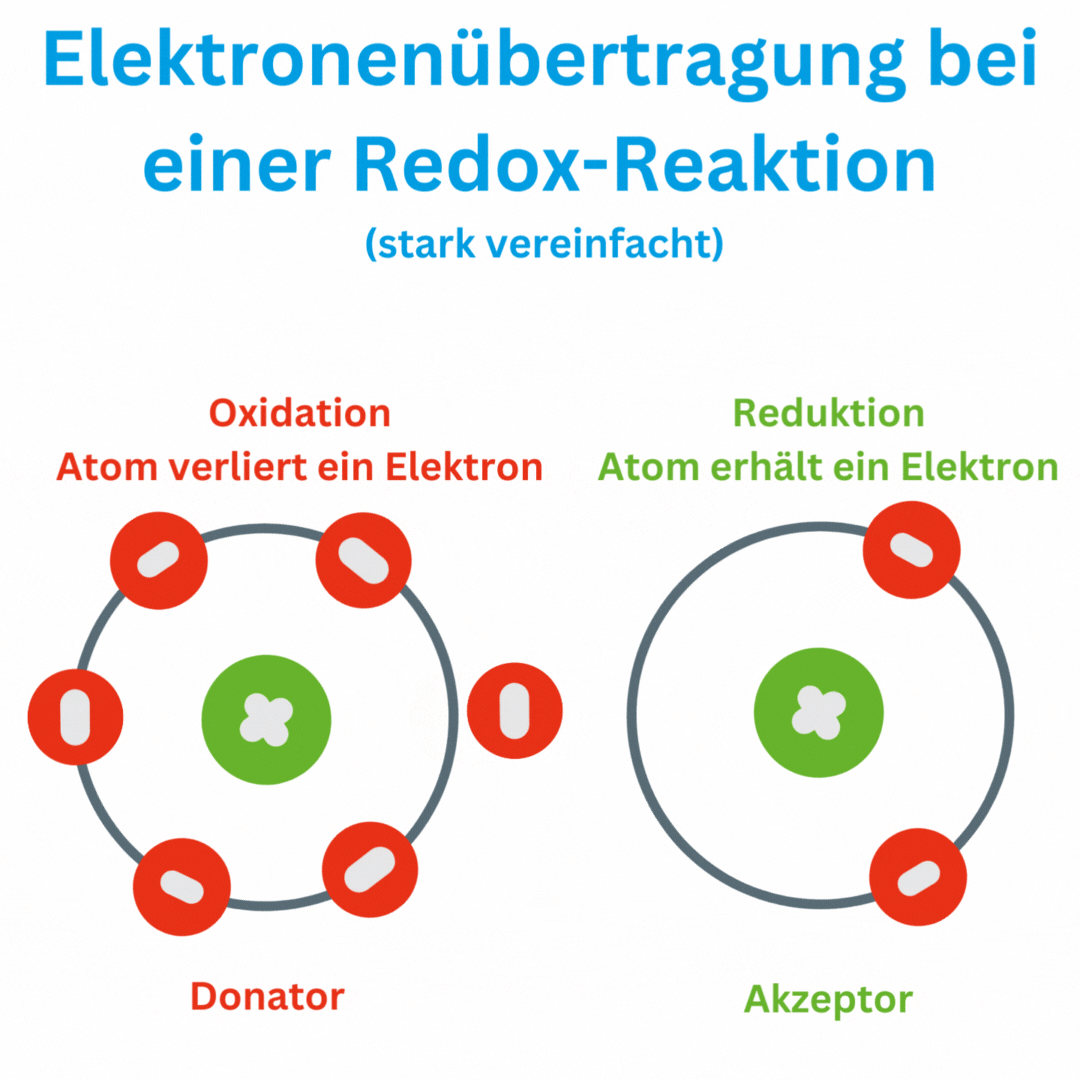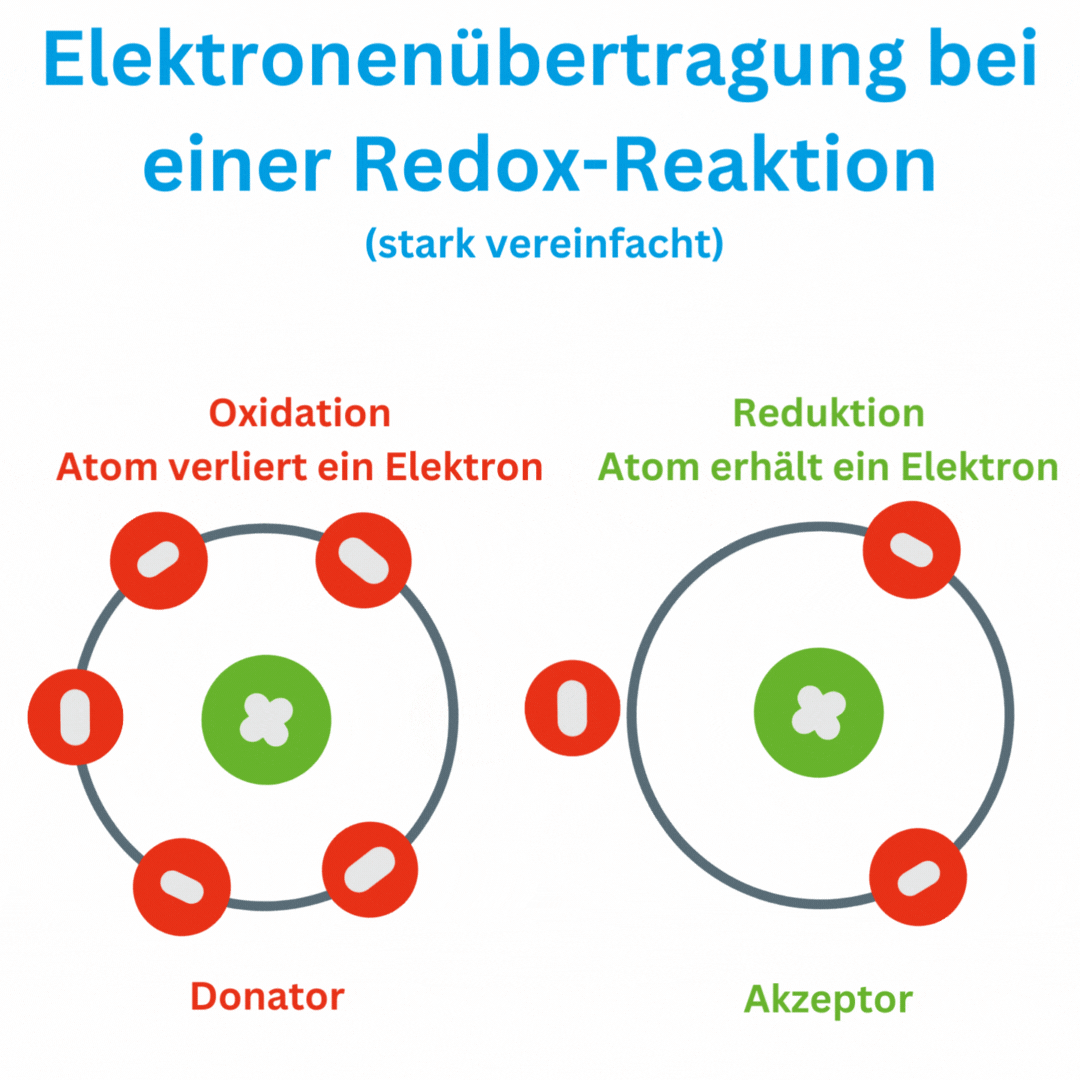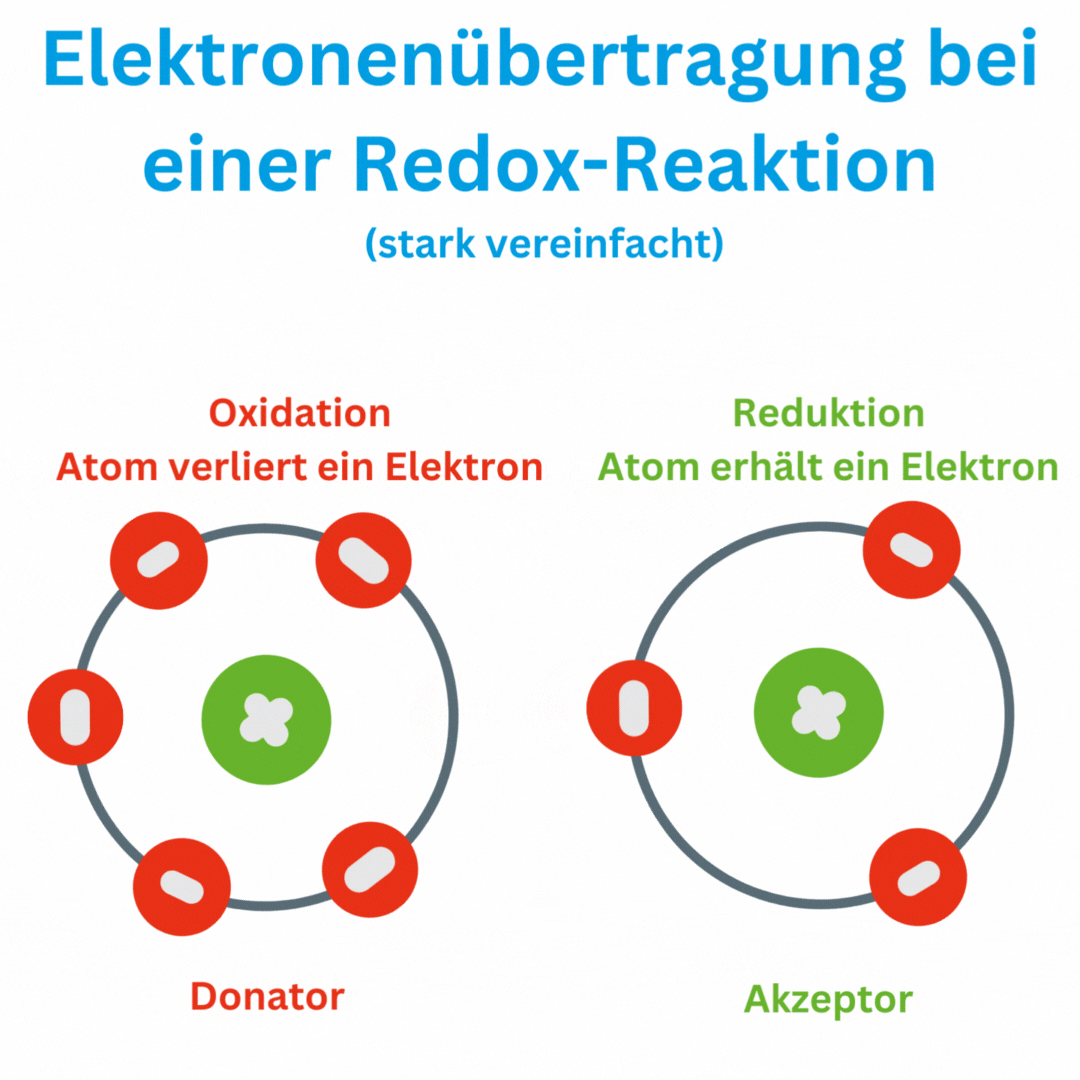
- Définition de la valeur redox : La valeur redox mesure la capacité d'une solution à accepter ou à donner des électrons. Elle se mesure en millivolts (mV). Un potentiel redox positif indique que la solution est plus susceptible d'être oxydée (émission d'électrons), tandis qu'un potentiel redox négatif indique un environnement plus réducteur (acquisition d'électrons).
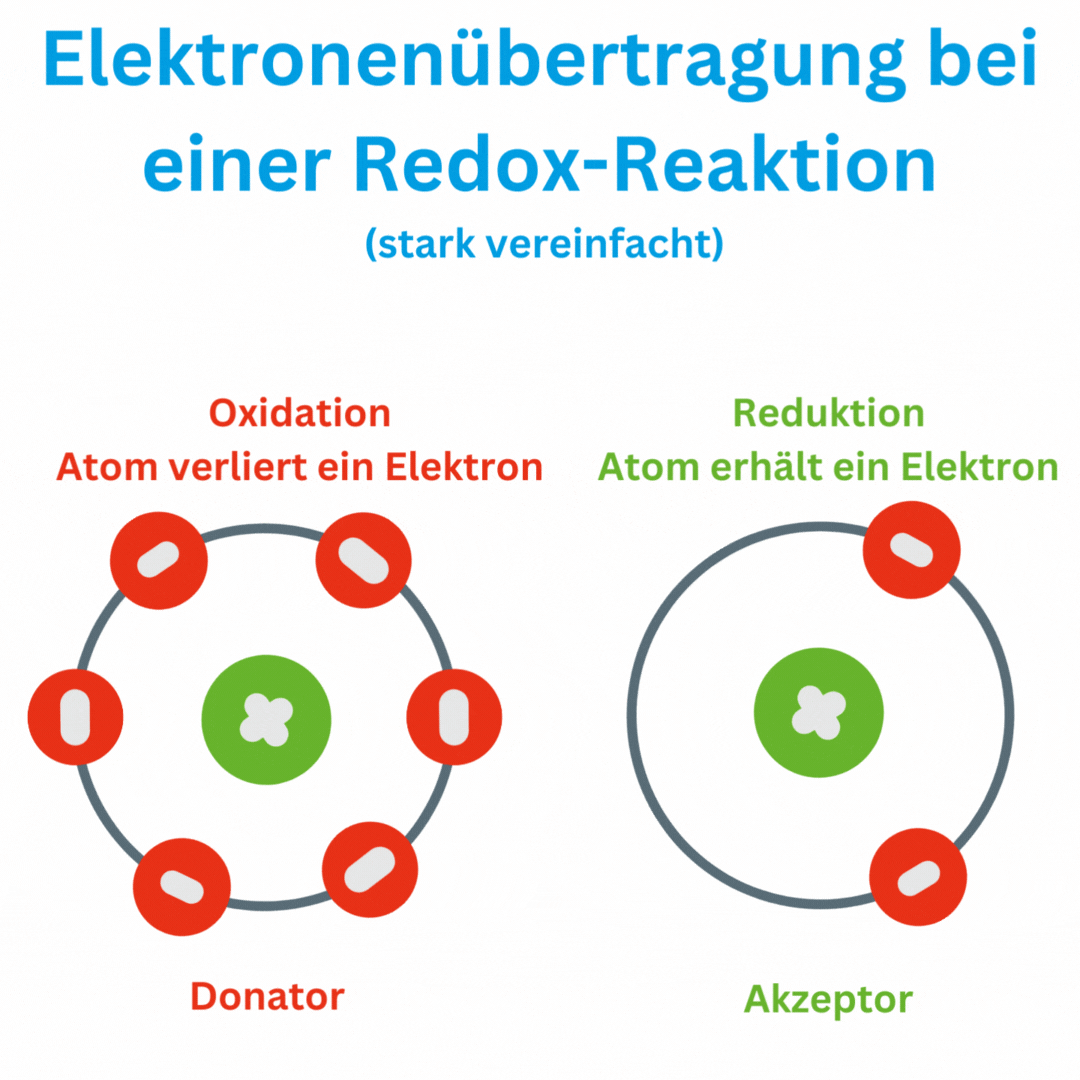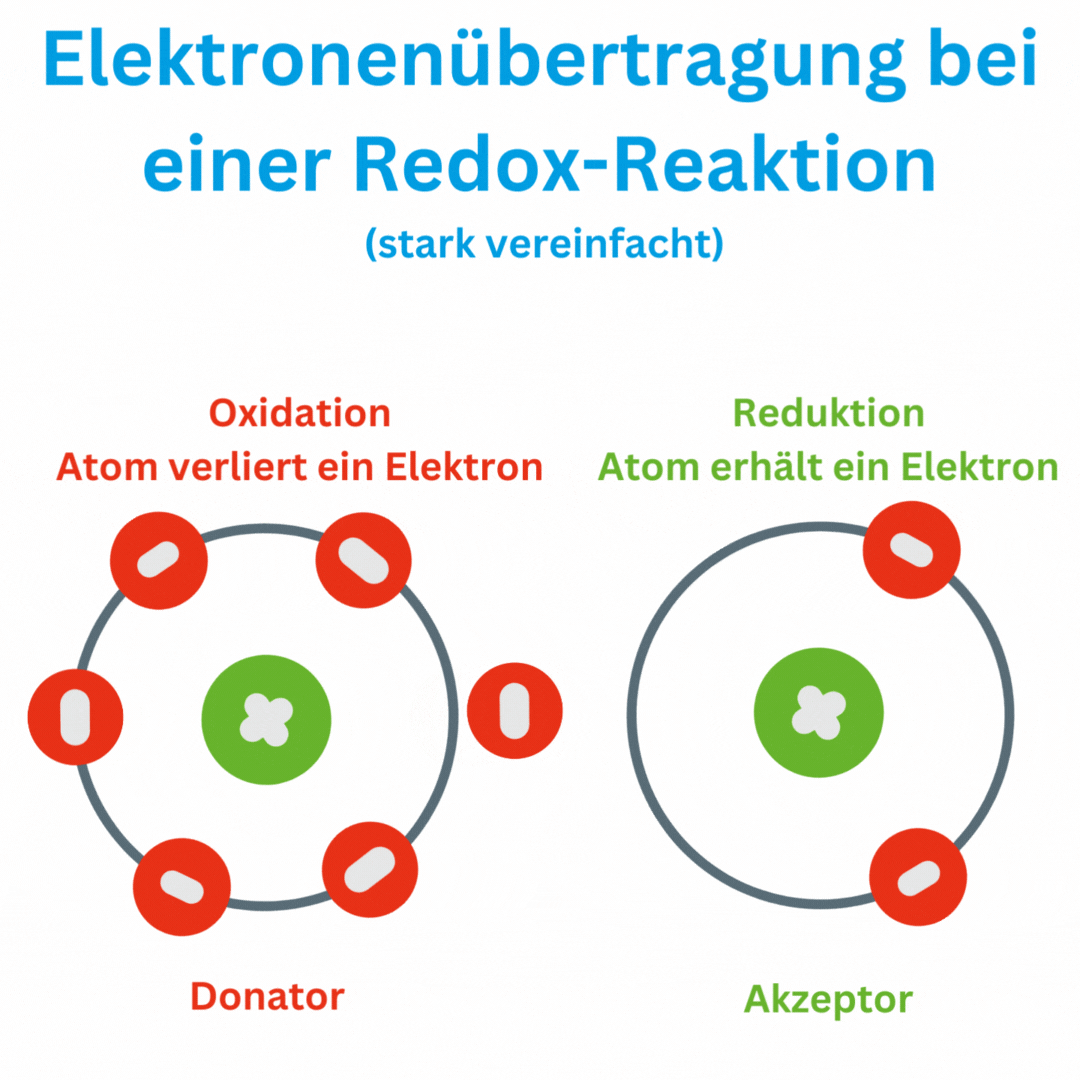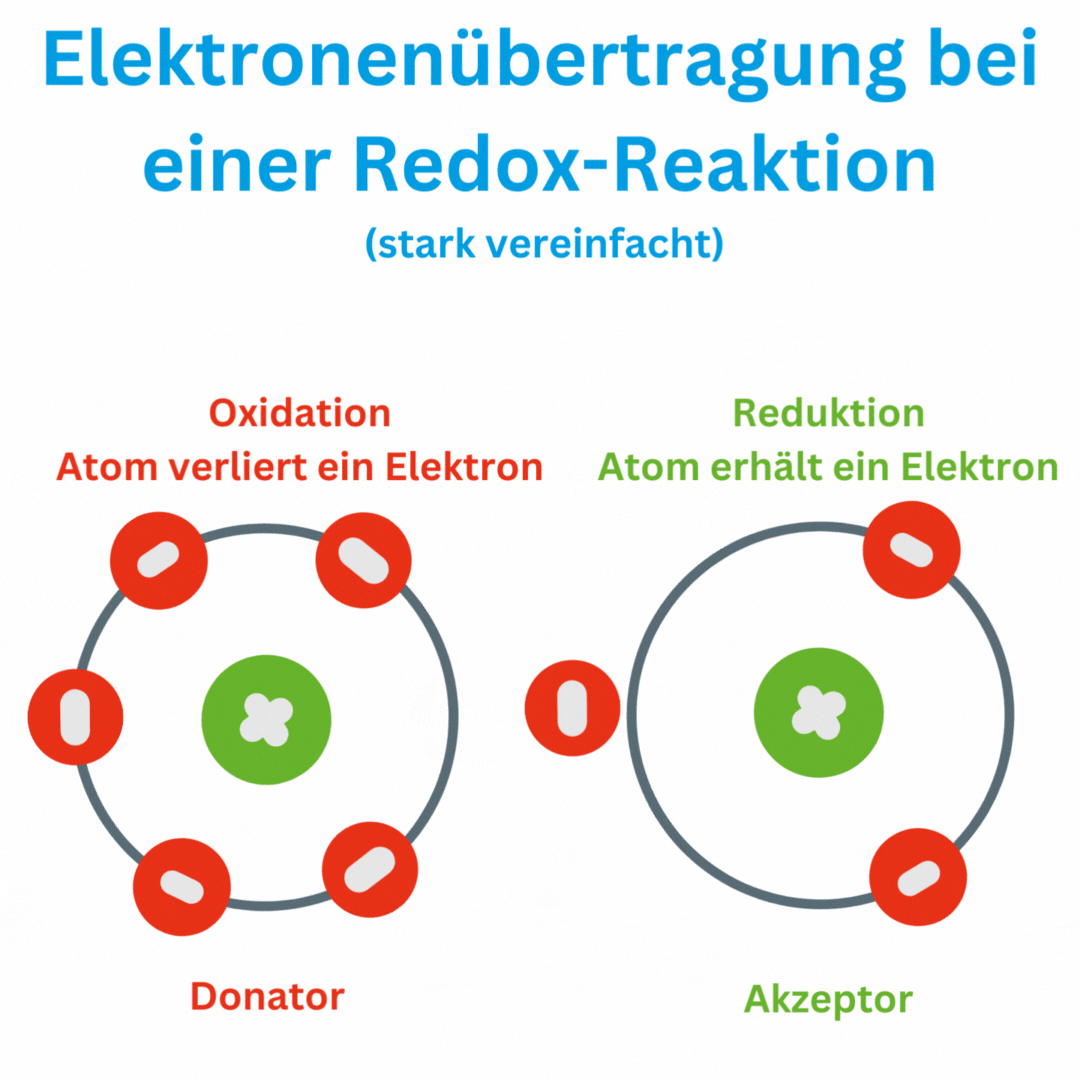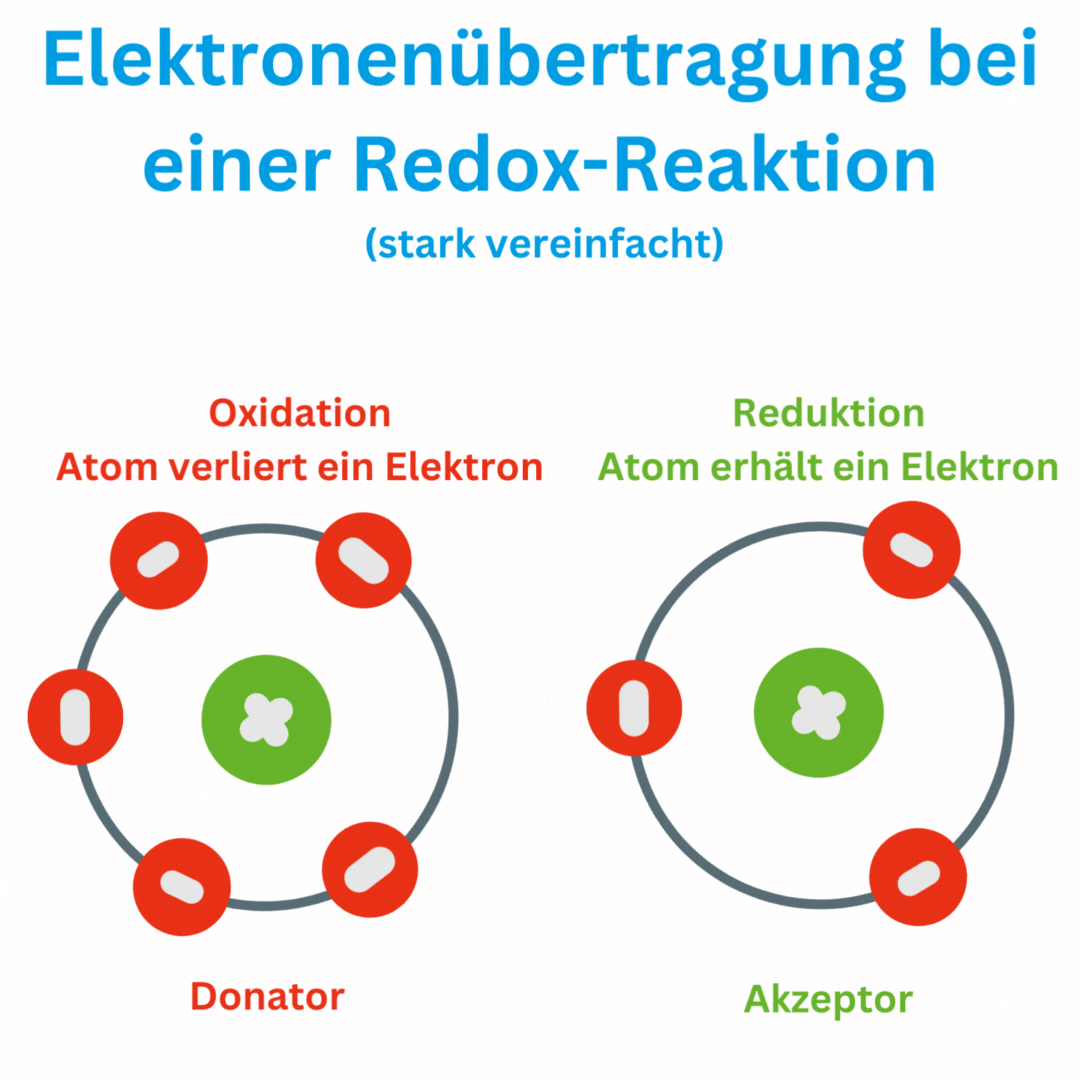
- Réactions redox : Une réaction redox, également connue sous le nom de réaction d'oxydo-réduction ou processus redox, est une réaction chimique dans laquelle des électrons sont transférés d'une substance chimique à une autre. Ce transfert d'électrons entraîne une modification des états d'oxydation des atomes ou des ions impliqués. Dans une réaction redox, il y a toujours deux réactions partielles :
Description technique de la réaction redox
Un moyen simple de détecter les réactions redox consiste à surveiller l’évolution des nombres d’oxydation des atomes ou des ions impliqués. Les nombres d'oxydation sont des nombres qui indiquent le nombre d'électrons qu'un atome possède ou abandonne dans un composé.
Exemple de réaction redox : L'oxydation de l'hydrogène (H2) en eau (H2O) est un exemple classique de réaction redox :
2 H2(g) + O2(g) → 2 H2O(l)
Dans cette réaction, l’hydrogène est oxydé (perd des électrons) tandis que l’oxygène est réduit (gagne des électrons). La molécule d'hydrogène (H2) est convertie en eau (H2O) et les électrons sont transférés de l'hydrogène à l'oxygène.
Les réactions redox sont cruciales dans de nombreux processus chimiques, biologiques et physiques, notamment la production d'énergie dans les batteries, la respiration des organismes vivants et l'oxydation des carburants dans les moteurs. Ils jouent un rôle fondamental en chimie et revêtent une grande importance dans de nombreux processus naturels et industriels.

Voici quelques aspects importants liés à la valeur redox de l’eau :
- Définition de la valeur redox : La valeur redox mesure la capacité d'une solution à accepter ou à donner des électrons. Elle se mesure en millivolts (mV). Un potentiel redox positif indique que la solution est plus susceptible d'être oxydée (émission d'électrons), tandis qu'un potentiel redox négatif indique un environnement plus réducteur (acquisition d'électrons).
- Réactions redox : Une réaction redox, également connue sous le nom de réaction d'oxydo-réduction ou processus redox, est une réaction chimique dans laquelle des électrons sont transférés d'une substance chimique à une autre. Ce transfert d'électrons entraîne une modification des états d'oxydation des atomes ou des ions impliqués. Dans une réaction redox, il y a toujours deux réactions partielles :
Description technique de la réaction redox
Un moyen simple de détecter les réactions redox consiste à surveiller l’évolution des nombres d’oxydation des atomes ou des ions impliqués. Les nombres d'oxydation sont des nombres qui indiquent le nombre d'électrons qu'un atome possède ou abandonne dans un composé.
Exemple de réaction redox : L'oxydation de l'hydrogène (H2) en eau (H2O) est un exemple classique de réaction redox :
2 H2(g) + O2(g) → 2 H2O(l)
Dans cette réaction, l’hydrogène est oxydé (perd des électrons) tandis que l’oxygène est réduit (gagne des électrons). La molécule d'hydrogène (H2) est convertie en eau (H2O) et les électrons sont transférés de l'hydrogène à l'oxygène.
Les réactions redox sont cruciales dans de nombreux processus chimiques, biologiques et physiques, notamment la production d'énergie dans les batteries, la respiration des organismes vivants et l'oxydation des carburants dans les moteurs. Ils jouent un rôle fondamental en chimie et revêtent une grande importance dans de nombreux processus naturels et industriels.
Domaines d'application de la valeur redox
Dans l'ensemble, la valeur redox est un paramètre important qui joue un rôle dans de nombreux domaines où la réaction chimique des substances dans l'eau ou dans d'autres solutions est importante. Cela peut aider à surveiller l’efficacité des processus et à évaluer la qualité de l’eau.
La valeur redox est utilisée dans le traitement de l’eau potable pour surveiller l’efficacité des processus de désinfection tels que la chloration. Un faible potentiel redox peut indiquer des contaminants organiques présents dans l’eau et qui doivent être éliminés lors de la désinfection.
Dans les piscines, la valeur redox est vérifiée pour s'assurer que l'eau est exempte de micro-organismes pathogènes. Un potentiel redox équilibré est important pour garantir une désinfection efficace.
Dans l’industrie, les niveaux redox sont surveillés dans divers processus, notamment la transformation des aliments et la production chimique. Il peut fournir des informations sur l’efficacité des réactions chimiques et le contrôle de la contamination.
Dans le cadre de la surveillance environnementale, la valeur redox de l'eau et du sol est mesurée pour obtenir des informations sur les conditions environnementales et la disponibilité des nutriments pour les organismes.
Le potentiel redox des eaux naturelles peut varier considérablement et dépend de divers facteurs tels que la teneur en oxygène, la température, le pH et la présence de matières organiques. Dans les eaux riches en oxygène, le potentiel rédox est généralement positif car l'oxygène est un puissant agent oxydant.
Que signifie une valeur redox négative ?
Oui, la valeur redox (potentiel d'oxydo-réduction, ORP) peut également atteindre des valeurs négatives telles que -180 mV et moins, selon les conditions chimiques et la composition ou le traitement de l'eau. Un ORP négatif indique que la solution ou l'eau a un environnement plus réducteur dans lequel les électrons sont acceptés plutôt que libérés. Cela signifie que l'eau potable est antioxydante et peut donc éliminer les radicaux libres dans l'organisme .
Certains scientifiques pensent que le fait que nous consommons de l’eau oxydante ou réductrice joue un rôle important. Werner Kollath en parle dans son livre « Les régulateurs de la vie – l'essence des systèmes redox » ou dans les recherches du scientifique français Lescour, qui fait la différence entre l'eau « vivante » et « morte » dans les sources curatives de Vichy sur la base de la valeur ORP. .
Viele Wissenschaftler vermuten oxidativen Stress als Verursacher mancher Krankheiten, wie z.B. Krebs oder Diabetes. Daher wird zunehmend empfohlen, Antioxidanten wie zum Beispiel Vitamin C zu sich zu nehmen, um diesen Stress vermindern zu können. Auch natürliche Lebensmittel wie Gemüse, Obst und Beeren haben eine natürliche antioxidative Wirkung. Daher ist es sehr naheliegend, dass ein niedrigerer oder negativer Redox-Wert von Trinkwasser auch eine gesunde Wirkung auf unseren Organismus hat.
Même si de nombreux arguments et indications, tels que les sources curatives, les effets antioxydants et la réduction des radicaux libres, suggèrent qu'un faible indice rédox dans l'eau potable est bénéfique, il n'existe actuellement aucune étude à long terme qui puisse clairement étayer scientifiquement cette hypothèse. Par conséquent, la seule option qui nous reste est de nous informer et de nous faire notre propre opinion. Les études ci-dessous et les références sur notre page d'information sur l'hydrogène dans l'eau montrent également que le lien entre l'indice rédox et l'hydrogène dans l'eau existe et est interdépendant.
La littérature sur le thème de l'eau et de l'eau elle-même sont des domaines très passionnants et variés et vous surprennent chaque jour avec de nouvelles informations - c'est pourquoi nous restons à l'écoute et sommes heureux de vous informer des nouvelles découvertes.
Quelques études très passionnantes dans ce contexte :
Effets de l'eau alcaline réduite sur les maladies gastro-intestinales
Et pour être complet, la différence entre la valeur redox et le potentiel redox
Valeur redox par rapport au potentiel redox
Même si la valeur rédox est souvent assimilée au potentiel rédox, il existe une différence physique - dans ce qui suit, nous nous concentrerons sur la valeur rédox ou l'ORP :
Valeur Redox (ORP – potentiel d'oxydo-réduction)
- La valeur redox, également connue sous le nom d'ORP (potentiel d'oxydo-réduction), est mesurée en millivolts (mV) et indique la tension électrique dans une solution ou un système généré par des réactions d'oxydo-réduction.
- La valeur redox est une mesure physique qui indique directement les propriétés électriques d'une solution.
- Une valeur redox positive plus élevée indique un environnement oxydant, tandis qu'une valeur redox négative inférieure indique un environnement réducteur.
Potentiel redox (Eh)
- Le potentiel rédox, symbolisé par Eh, est un facteur important de la valeur rédox et indique la capacité d'une solution à accepter ou à donner des électrons.
- Le potentiel redox est une grandeur thermodynamique et se mesure en volts (V).
- Elle est basée sur l'équation de Nernst et dépend de la concentration des espèces rédox impliquées et de la température.
- Le potentiel rédox est une quantité intensive qui a une valeur unique pour une réaction rédox spécifique dans des conditions données.
Valeur Redox (ORP – potentiel d'oxydo-réduction)
- La valeur redox, également connue sous le nom d'ORP (potentiel d'oxydo-réduction), est mesurée en millivolts (mV) et indique la tension électrique dans une solution ou un système généré par des réactions d'oxydo-réduction.
- La valeur redox est une mesure physique qui indique directement les propriétés électriques d'une solution.
- Une valeur redox positive plus élevée indique un environnement oxydant, tandis qu'une valeur redox négative inférieure indique un environnement réducteur.
Potentiel redox (Eh)
- Le potentiel rédox, symbolisé par Eh, est un facteur important de la valeur rédox et indique la capacité d'une solution à accepter ou à donner des électrons.
- Le potentiel redox est une grandeur thermodynamique et se mesure en volts (V).
- Elle est basée sur l'équation de Nernst et dépend de la concentration des espèces rédox impliquées et de la température.
- Le potentiel rédox est une quantité intensive qui a une valeur unique pour une réaction rédox spécifique dans des conditions données.
En résumé, la valeur redox est une mesure de la tension électrique dans une solution due aux réactions d’oxydo-réduction, tandis que le potentiel redox est une propriété thermodynamique qui décrit la capacité d’une solution à transférer des électrons.
La conversion du potentiel rédox (RH2) en millivolts (mV) nécessite l'utilisation d'une équation de Nernst qui décrit la relation entre le potentiel rédox, l'activité ou la concentration des espèces rédox impliquées et la température. L'équation de Nernst est :
Conversion de la valeur redox en potentiel redox
La conversion du potentiel rédox (RH2) en millivolts (mV) nécessite l'utilisation d'une équation de Nernst qui décrit la relation entre le potentiel rédox, l'activité ou la concentration des espèces rédox impliquées et la température. L'équation de Nernst est :
- RH2 est le potentiel redox en mV.
- L'étalon RH2 est le potentiel redox standard pour la réaction redox en question à une température spécifique, généralement 25°C (298,15 K).
- R est la constante universelle des gaz (8,314 J/(mol K) ou 0,008314 kJ/(mol K)).
- T est la température en Kelvin (°C + 273,15).
- n est le nombre d'électrons impliqués dans la réaction redox.
- [Oxydant] est l'activité ou la concentration de l'agent oxydant.
- [Agent réducteur] est l'activité ou la concentration de l'agent réducteur.
Notez que l’activité des espèces rédox (oxydants et agents réducteurs) doit être prise en compte car elle détermine la contribution réelle à la réaction rédox. L'activité peut varier en concentration et dépend du type d'espèce et des conditions.
La conversion de RH2 en mV nécessite la connaissance du potentiel rédox standard pour la réaction rédox en question et des concentrations ou activités des espèces rédox impliquées. Il est également important de s'assurer que la température est convertie en Kelvin.
Veuillez noter que la conversion exacte de RH2 en mV dépend de la réaction redox et des conditions spécifiques. Vous aurez peut-être besoin d'informations spécifiques sur votre réaction redox pour effectuer une conversion précise.
















Laisser un commentaire
Tous les commentaires sont modérés avant d'être publiés.
Ce site est protégé par hCaptcha, et la Politique de confidentialité et les Conditions de service de hCaptcha s’appliquent.